LEARNING OBJECTIVES
- ICH GCP and ICH GCP R3 Addendum
- EU Clinical Trials Regulation (EU CTR)
- Dutch legislation: Medical Research Involving Human Participants Act (WMO), WGBO and Wet BIG
- Roles in clinical research
- Privacy in clinical research (GDPR)
- Informing research participants
- Essential records
- Review by the Ethics Committee
- Safety reports and safety of your participants, incl. AEs, SAEs, and SUSARs
- Quality management
- Amendments and derogations
- Final report
- Audits and inspections
DESCRIPTION
The expert course to GCP in the Netherlands is the self-paced online training solution for researchers, pharma professionals, and research staff who conduct clinical trials in the Netherlands, and need to be aware of the Good Clinical Practice guidelines, EU laws, and the Medical Research Involving Human Participants Act (WMO) applicable to clinical research with human participants. It is the best choice for those who like the flexibility of online learning at their own pace and time. This course translates the regulatory framework to practice and gives you the tools to directly implement the knowledge in your daily practice.
- Transcelerate acknowledged WMO/GCP certificate
- Efficient and interactive learning
- Easy accessible via smartphone, tablet, or desktop
- Self-paced and modular
- Accredited by PE-online quality registers
The course consists of 7 online training modules in a logical order: from the design to close-out of a clinical trial. It represents a total workload of 10-12 hours. The modules are divided into chapters of 10-30 minutes and consist of the guidelines which apply to international clinical trials, including the Declaration of Helsinki, ICH GCP E6 Addendum R3, EU Directives 2001 and 2005, the EU Privacy law, Medical Research Involving Human Participants Act (WMO), WGBO and Wet BIG.
After you have completed all components of the GCP e-learning course for clinical trials in the Netherlands you will receive a WMO/GCP Certificate, recognized by Transcelerate and accredited by many quality registers.
All training courses include one-year access to the online training. With our continuous learning model, we will keep you up-to-date with changing regulations and guidelines.
Enroll now to get started with the online learning modules on your smartphone, tablet, or desktop computer.
TRAININGSINHOUD
Module: Introductie
- Inleiding in medisch wetenschappelijk onderzoek
- Typen klinisch onderzoek (interventioneel, therapeutisch, multi/singlecenter)
- Geschiedenis wet- en regelgeving klinisch onderzoek (Code van Neurenberg, Verkl. van Helsinki)
- De beginselen van ICH GCP, inclusief R3 Addendum
- Wet- en regelgeving klinisch onderzoek Europa (EU directives 2001 en 2005, EU Verordening)
- Wettelijk kader zorg en klinisch onderzoek in Nederland (WMO, WGBO, AVG) en reikwijdte
- De rollen in klinisch onderzoek (sponsor, METC, bevoegde instantie, monitor, auditor, onderzoeker, research professional)
- Extra eisen aan geneesmiddelenonderzoek
- Fases van geneesmiddelenonderzoek
- Begrippen en afkortingen in medisch wetenschappelijk onderzoek
Module: Opzet
- Protocol ontwikkeling en inhoud
- Selecteren onderzoeksteam
- Selectie van onderzoekers en onderzoekslocaties
- Selectiecriteria onderzoekers en onderzoekslocaties
- Opstellen en opbergen essentiële documenten (Investigator Site File)
- Risico-inventarisatie
- Kwaliteitsborging opzetten: monitoringplan, auditing, DSMB, SOPs
Module: Voorbereiding
- Onderzoeksproduct verpakken, etiketteren, invoeren en leveren
- Opstellen productinformatie (Investigators Brochure, IMPD)
- Opstellen patiënten informatie en informed consent met Model Proefpersoneninformatie 2019
- Contracten en overeenkomsten
- Privacy wetgeving (AVG)
- Verzekeringen (proefpersonenverzekering en aansprakelijkheid)
Module: VGO
- Het proces
- De lokale haalbaarheidsprocedure in beeld
- Voor welke typen onderzoek is de VGO van toepassing
- De 4 stappen van de procedure Lokale Haalbaarheid
- Deel A en deel B van de VGO
- Verhouding VGO tot andere documenten
- De tijdslijnen van de procedure Lokale Haalbaarheid
Module: Indiening
- Samenstelling standaard onderzoeksdossier
- Samenstelling en procedure toetsingscommissie (METC of CCMO)
- Toetsing door ethische toetsingscommissie
- Toetsing door bevoegde instantie (CCMO of Ministerie van VWS)
- Beoordelingstermijnen en wijzigingen
- Toetsingsproces en goedkeuring
Module: Start onderzoek
- Taken delegeren en initiatievisite
- Levering, opslag en gebruik onderzoeksproduct in een onderzoek
- Rekrutering van proefpersonen
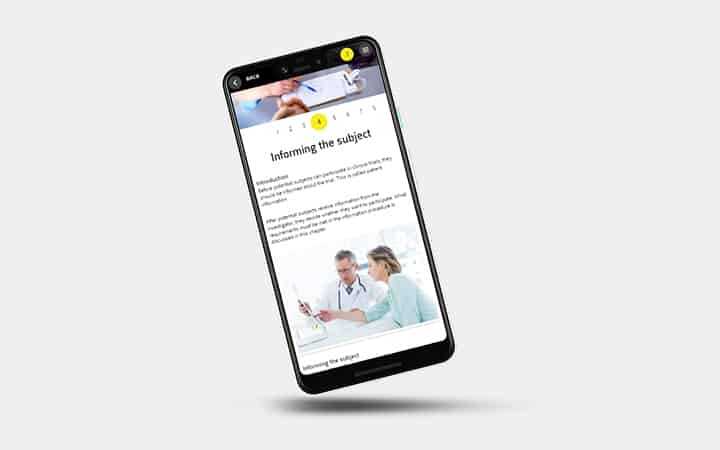
- Informeren van proefpersonen
- Informed Consent procedure en toestemming
- Randomiseren en coderen
- Privacy van gegevens
- Eisen aan onderzoek met kwetsbare proefpersonen
Module: Uitvoer
- Amendementen, deviaties en wijzigingen in protocol en onderzoek
- Toevoegen van nieuwe onderzoekslocaties en onderzoekers
- Veiligheidsrapportages (AE/SAE/SUSAR)
- Veiligheid proefpersonen medische zorg en DSMB
- Documentatie en datamanagement (source, CRF, database)
- Monitoring/Auditing /Inspectie
- Kwaliteitsborging en risico management (R3 update)
- Voortgangsrapportages
Module: Afronding en archivering
- Afronding onderzoek
- Voortijdige beëindiging
- Melden einde onderzoek
- Eisen aan het eindrapport / Clinical Study Report
- Opslag en archivering onderzoeksdocumentatie
- Bewaartermijnen onderzoeksdocumentatie
Module: Kennistoets
- 40 vragen
- Beschikbaar in Nederlands
- Feedback per vraag (achteraf)
- 3 pogingen
- Gehaald bij een score van 80 of hoger