We krijgen steeds meer vragen over de EU CTR. De overgangsperiode loopt bijna af en dat merken we. Vandaar dat we graag de belangrijkste zaken met jullie delen:
De Clinical Trials Regulation (Regulation (EU) No 536/2014) of, kort gezegd, de EU CTR is op 31 januari 2022 in werking getreden. Om een soepele overgang van lopende studies mogelijk te maken, is een overgangsperiode van drie jaar vastgesteld. Op 30 januari 2025 dus, moeten alle lopende onderzoeken voldoen aan de eisen van de EU CTR en bovendien opgenomen zijn in het Clinical Trial Information System (CTIS). Geneesmiddelenonderzoeken die geautoriseerd zijn onder de EU Directive No 2001/20/EC moeten vóór die tijd of beëindigd of omgezet zijn.

Beantwoord voor jezelf de volgende vragen:
- Is jouw geneesmiddelenonderzoek geautoriseerd onder de EU Directive N0 2001/20/EC?
- Ligt de verwachte einddatum na 30 januari 2025? En/of zijn na 30 januari 2025 nog onderzoekslocaties actief in een Europese lidstaat of een land in de EEA?
- Zijn er voor dat onderzoek nog substantiële amendementen of goedkeuringen nodig voor het onderzoek?
Als de eerste ‘ja’ gevolgd wordt door nog een ‘ja’, dan moet jouw onderzoek in 2024 worden omgezet naar de CTR. Dit is een administratief proces en zal enige tijd in beslag nemen.
Op welke manier en op welke termijn?
De omzetting initieer je als sponsor via een indiening van een zogenaamde ‘transition trial’ in het CTIS. Documenten die je moet uploaden vallen onder het ‘simplified dossier’, waarvan de aan te leveren stukken in de afbeelding hieronder staan:
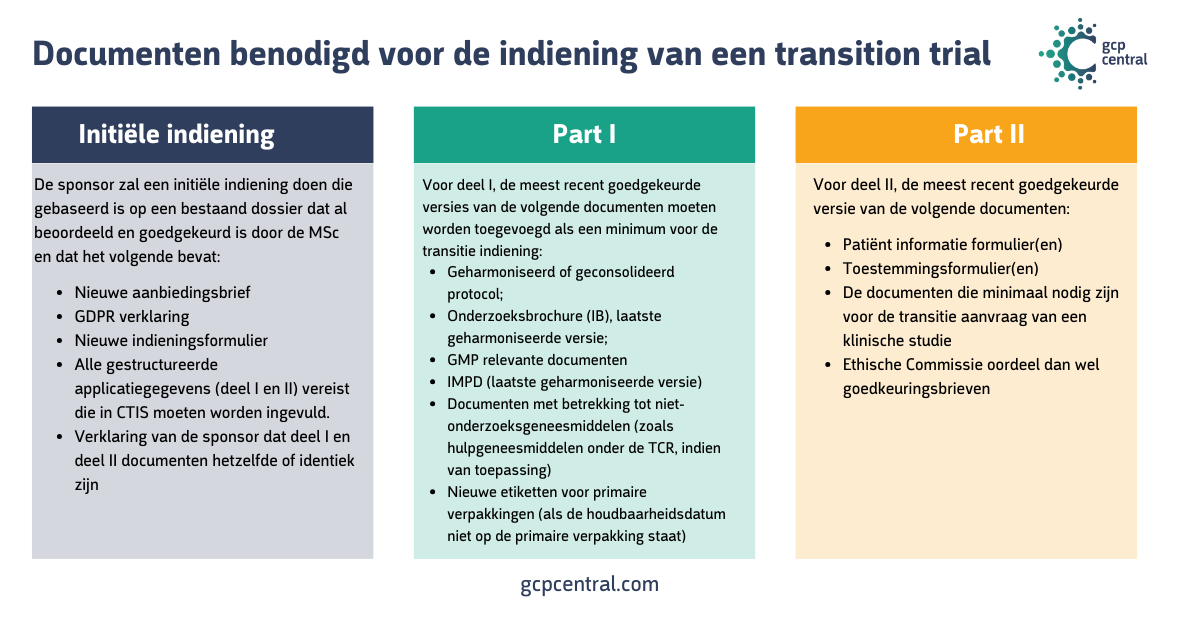
Houd er hierbij rekening mee dat:
- documenten die al zijn ingediend, zoals het protocol, de investigators brochure en het Investigational Medicinal Product Dossier, moeten worden geharmoniseerd of aangepast voor de verschillende EU lidstaten.
- voor multinationale trials waar documenten geharmoniseerd worden tussen de lidstaten, eerst onder de CRD een amendement moet worden ingediend ter goedkeuring van dit geharmoniseerde document, voordat wordt overgegaan tot indiening van de transition trial in CTIS.
- dit enige tijd in beslag kan nemen!
Wij adviseren met klem om jouw onderzoeken die overgezet moeten worden naar de CTR niet later in te dienen dan september 2024. De standaard tijdslijnen van de beoordeling van een transition trial is 60 dagen. Voor multinationale onderzoeken is een versnelde procedure mogelijk, waarbij de beoordeling wordt geschat op maximaal 22 dagen. De beoordeling van de lidstaten beperkt zich tot een minimum en controleert of het ingediende dossier voldoet aan de eisen van de CTR. Documenten die eerder zijn beoordeeld door een ethische commissie worden niet opnieuw inhoudelijk beoordeeld.
Nog 2 tips voor een soepele overgang naar de EU CTR:
- Zorg ervoor dat je geen documenten indient die niet vereist zijn. Dit levert alleen maar vragen op van de beoordelende commissie en dus mogelijk vertraging.
- Als er tijdens het indientingsproces in CTIS documenten gevraagd worden die wel verplicht zijn voor de EU CTR, maar níet vereist waren onder de EU Directive, dan mag je daar een leeg document uploaden. Zo zorg je dat je door kan gaan met de stappen van het transition trial dossier.
Kortom, geen paniek in de tent. Echter, wel actie vereist als jouw geneesmiddelenonderzoek nog omgezet dient te worden.




